



非常有幸在今年11月,张骐博士分别收到了两家医药媒体:Medspace(药视声)与New Drug Club(新药帮)邀请,进行了两次名为《深入阐述报批及工艺开发中液相杂质的研究》的主题演讲 药物的纯度(Purity)对安全与有效性有着直接与深刻的影响。根据ICHQ6B指南,由于生物制品的高异质性,“纯度” 非单一维度概念,而是一个非常依赖于分析方法的多维度指标。根据不同的分析方法,从产品中可以分析出以下4种与所设计分子化学结构不同的物质,它们分别是:产品相关物质(Product-related substance), 产品相关杂质(Product-related impurities),工艺相关杂质(Process-related impurities)和 污染物(Contaminants)。 当我们使用灵敏的分析方法分析出产品的杂质时,往往需要知道这些杂质的化学结构究竟与主峰有何不同。这类研究能够让监管机构明晰厂家对产品的深刻了解;另外更重要的是,杂质的化学结构鉴定能够为工艺的改进提供重要线索,能够有效帮助企业提升产品纯度和质量,提高生产效率。
1.浓缩低浓度杂质回收率下降。
2.多维液相与质谱联用杂质鉴定:
3.浓缩低浓度杂质回收率下降。
4.目标杂质占比越低,收集后浓缩的回收率越低。1%左右的杂质回收率只有1-5%。
5.回收率低导致收集时间过长,造成目标杂质二次降解,从而导致化学结构与活性分析结果产生偏差。
1.拥有针对性的特有技术来解决杂质收集中的上述问题
2.收集馏分中的目标杂质浓度过低(ug/mL级别)无法直接用于检测。
❄️0.1%的杂质结构鉴定只需要1周。
❄️0.1%杂质多肽结构鉴定只需3天,蛋白结构鉴定只需1周,无须收集。
3.杂质收集后寄给用户:
❄️速度快:0.1%的杂质收集100μg只要一周。
❄️纯度高:返上样纯度90%情况下>=85%。
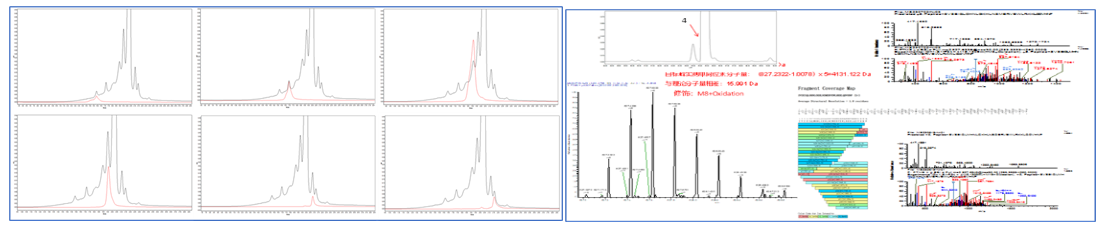



在分析DXD(Deruxtecan)类ADC时,你是否遇到过icIEF(全柱成像毛细管等电聚焦)结果不稳定、酸碱峰漂移不定的问题?其实,答案就藏在DXd的“E内酯环”里。本文带你一图看懂原因,并介绍我们如何通过在线预混iCE系统完美解决这一问题。
在使用icIEF分析ADC样品时,不少实验者发现一个现象:同一样品如果排队等待时间过长,酸碱组分比例会变化导致图谱逐渐偏酸,从而影响酸碱组分比例会发生持续变化。
这一现象的根源在于Payload为DXd的分子结构。DXd属于Camptothecin类DNA拓扑异构酶Ⅰ抑制剂,含有一个关键结构——E内酯环。在样品与碱性两性电解质(Ampholyte)混合后,E内酯环会发生水解开环反应,生成羧酸形式。这会改变分子的电荷状态,导致icIEF图谱中酸峰增强、碱峰下降。因此icIEF结果酸碱峰漂移不定。

此外,含有类似内酯或不稳定结构的payload,如:Maytansinoid、PBD、Auristatin、Calicheamicin等,也可能出现类似问题。



传统的蛋白质组学是针对组织大量细胞样本进行分析,获得的是均质化后的结果,掩盖了单细胞的个体差异,这种方法受限于群体研究平均效应,无法揭示单个细胞之间存在的显著异质性和动态变化。为了揭示细胞异质性,帮助我们更清晰地理解细胞在特定生理、病理或治疗状态下的动态变化,单细胞蛋白质组学作为一种强大的技术,使得我们能够对单个细胞进行蛋白质组学分析,揭示细胞间的差异性和了解细胞的功能和调控机制。
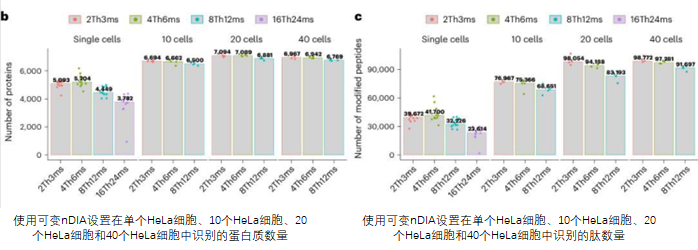
单细胞蛋白质组学技术近年来取得了显著进步,在单细胞蛋白质组学Chip-Tip方法提升了单细胞蛋白质鉴定的灵敏度、覆盖率和可靠性,能够在单个HeLa细胞中鉴定出超过5000种蛋白质和40000种肽段。Chip-Tip工作流程在灵敏度和通量方面为单细胞蛋白质组学设定了新的标杆,并在基础生物学和生物医学领域中被广泛应用于鉴定细胞类型特异性标志物和治疗靶点。
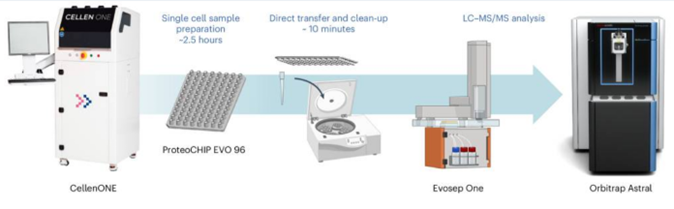
在单细胞蛋白质组学样本制备中,这种超高灵敏度的工作流程,减少了表面吸附损失、缓冲液蒸发和移液步骤,以提高重现性和灵敏度。该工作流程能够在纳升级别处理单细胞样本,同时制备多达96个细胞的蛋白质组学样本。



稳定性试验是贯穿于整个药品研发、临床、上市及上市后质量研究的重要内容,同时也是产品质量标准制定的基础,其检测及数据分析质量控制也显得极为重要。稳定性研究和质量标准的制定二者紧密关联:稳定性研究为质量标准的合理性提供数据支撑,而质量标准则通过明确限度和检测要求,确保药品在整个生命周期内的质量可控。
温栗生物在稳定性样品检测及数据分析质量控制方面可以提供哪些保障,以确保试验可以监测稳定性研究的结果,以确保其安全性、有效性和质量呢?为此我们基于《中国药典》2020年版针对生物制品增订的"生物制品稳定性试验指导原则",以及ICH指南: Q1 (STABILITY TESTING OF DRUG SUBSTANCES AND DRUG PRODUCTS -DRAFT VER-SION) Q5C(STABILITY TESTING OF BIOTECHNOLOGICAL/BIOLOGICAL PRODUCTS) 在内部制定了质量管理体系规范执行样品检测及数据分析全流程,具体体现在以下几方面:



蛋白琥珀酸铁口服液在报批过程中往往需要做进一步的质量研究,比如:酪蛋白亚型比例、等电点的方法学研究;中间体琥珀酰蛋白(IP-1)中不同酪蛋白的比例研究;自制制剂和参比制剂提取后原料药的对比研究,包括分子量与分子量分布、氨基酸分析、蛋白琥珀酸中不同酪蛋白比例(如,a/β酪蛋白比值等)酪蛋白与琥珀酸酐的酰化反应位点和酰化程度、铁价态及载铁结构等;研究起始原料酪蛋白和降解杂质琥珀酸酰化蛋白等。温栗生物可以提供如下表征方法:




2024年6月12日
苏州凯劳/温栗生物受邀入驻佰仕问问平台,希望通过构建大分子结构表征服务领域的专业对话生态,助力行业技术交流和创新发展。
佰仕问问是问答互动的形式,前期的内容以首席科学家张骐博士受邀在百世药学院的三场深度技术讲座为基石,精选其与同业专家互动研讨的精华内容,打造结构化知识图谱。现将这些探讨内容分享在佰仕问问平台,展示如下:




2024年3月21日




2022年2月21日




2021年3月26日





2020年12月4日




2020年9月6日




2020年7月26日




2019年11月24日




2019年8月23日


